
이온결합(ionic bonding): 금속과 비금속 원자 또는 암모니움과 같은 다중 원자 사이에서 형성된 화학결합의 한 형태로 전자의 이동으로 인한 이온 간의 정전기적 인력으로 결합이 생성된다.
- 이온화에너지가 작은 금속원소가 전자를 잃어 양이온이 되고, 전자친화도가 큰 비금속원소가 전자를 얻어 음이온이 된 이후 이 양이온과 음이온의 정전기적 인력에 의해 결합한다.

그림 1. ionic bonding의 대표적인 예로 Na와 Cl의 결합을 들 수 있다.
이온결합의 퍼텐셜 에너지(격자에너지의 크기)

- 이온결합의 퍼텐셜에너지를 보존력(conservative force) 식에 대입하면 '쿨롱의 법칙'을 유도할 수 있다. ⇒ 전기적 힘은 경로에 무관한(경로비의존성) 힘으로 이온결합에서의 정전기적 인력 역시 전기적 힘이다.
▼ 보존력
https://blog.naver.com/sortie0228/221852358881

[고전역학] Chapter 13. 힘과 에너지의 관계
#물리학 #고전역학 #퍼텐셜에너지 #중력퍼텐셜에너지 #전기퍼텐셜에너지 #보존력 #보존력일 #보존력성질 #...
blog.naver.com
▼ 쿨롱의 법칙
https://blog.naver.com/sortie0228/221775090763

[전자기학] Chapter 1. 쿨롱의 법칙
#물리학 #전자기학 #쿨롱의법칙 #양전하 #음전하 #프랭클린 #기본전하량 #전하량보존의법칙 #양자화된전하 ...
blog.naver.com
격자에너지
lattice energy: 기체 상태의 양이온과 같은 상태의 음이온이 이온결합함으로써 고체 이온 결정을 형성할 때 발생하는 에너지(발열반응)
만약 lattice energy를 고체 이온 결정에서 무한대의 거리로 기체 양이온 혹은 음이온을 반대 이온으로부터 떼어낼 때 필요한 에너지로 기술하면, 이때 lattice energy는 '흡열과정'에서의 에너지라고 할 수 있다.
- 반대로, 이온결합을 할 경우 lattice energy는 '결정화에너지'라는 또 다른 이름을 갖는다.

그림 2. lattice energy는 엔탈피 변화량으로 표현된다.
[그림 2]에서 만약 Na+와 Cl-의 두 이온이 NaCl을 형성한다면 격자에너지는 ΔH<0(발열에너지) and ΔH=-787kJ/mol의 수치로 표현될 것이다.
격자에너지 크기(V)의 특징
1. 양이온의 중심과 음이온의 중심 간 거리가 가까울수록 격자에너지 V의 절대값은 커진다.
2. 양이온의 양전하량과 음이온의 음전하량의 곱이 클수록 격자에너지의 절대값은 크다.
V는 즉, (1)이온의 크기와 (2)이온의 전하량에 매우 큰 영향을 받는다.


Erwin Madelung, 1881-1972, German
3. 마델룽(Madelung) 상수 ⇒ Madelung constant 값이 클수록 lattice energy의 값이 크다.
Madelung constant는 이온결합물의 배치 구조 중 양이온과 음이온의 배위수(양이온/음이온 배위수)에 매우 큰 영향을 받는다.

그림 3. 이온결합은 차원에 따라 특정한 결합 구조를 갖는다.
- NaCl의 배위수는 [그림 4]를 통해 쉽게 확인할 수 있다.
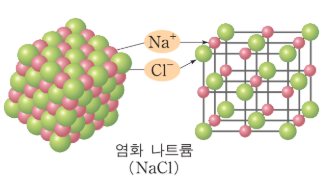
그림 4. 한 개의 Na를 두고 여섯 개의 Cl이 둘러싸고 있고, 반대의 경우도 마찬가지이다. 따라서 양이온/음이온 배위수는 6:6이다.
격자의 형태에 따라 M의 값은 다음과 같이 표로 정리할 수 있다.

그림 5. Madelung 상수는 M으로 표현한다.

- A:C는 양이온/음이온 배위수를 나타낸다.
#화학 #일반화학 #이온결합 #격자에너지 #이온결합퍼텐셜에너지 #마델룽상수 #LatticeEnergy #MadelungConstant #격자에너지크기의특징
'대학화학' 카테고리의 다른 글
| [G. Chem] 열화학 기초 | Basic Ideas of Thermodynamics (0) | 2020.04.19 |
|---|---|
| [G. Chem] 20. 마델룽 상수(Madelung Constant) (0) | 2020.04.11 |
| [G. Chem] 18. 전기음성도(Eletronegativity) (0) | 2020.04.11 |
| [G. Chem] 17. 전자친화도(Electron Affinity) (0) | 2020.04.05 |
| [G. Chem] 16. 이온화에너지(Ionization Energy) (0) | 2020.04.05 |