
일전자계(one electron system): 핵이 한 개 이고 그 주위에 전자 역시 한 개인 화학종
- 전자의 에너지 준위(energy level)은 전자 궤도인 주양자수의 값에 의해서'만' 결정
※ 주양자수(principle quantum number, n)
전자는 원자핵을 중심으로 전자궤도를 이루며 특정한 상태로 존재하는데, 이때 궤도는 몇 종류의 '불연속적인 양'으로 결정된다. 여러가지 불연속적인 양 중 주양자수는 전자의 에너지 준위를 결정한다.

그림 1. 주양자수의 도식
주양자수에 의한 전자의 에너지 준위 식은 다음과 같다.
전자의 에너지 준위

- n: principle quantum number
- Z: 원자번호
- R: 리드버그 상수
■
예를 들어 수소원자의 전자의 에너지 준위는 다음과 같이 구할 수 있다.

수소원자의 주양자수 n=2인 전자의 에너지 준위는 고로,

이다.
한편 헬륨 +1가 이온(He^+)의 전자의 에너지 준위는 다음과 같이 구한다.

헬륨의 원자번호가 2이고, 2개의 전자를 갖는 중성 헬륨으로부터 1개의 전자가 제거되었기 때문에 일전자계의 전자의 에너지 준위 식을 사용했음에 유의하자.
EXAMPLE. 전자의 에너지 준위
수소원자 내의 전자가 주양자수(n) 1에서 n=∞로 이동하는 데 얼마의 에너지를 필요로 하는가?
SOLUTION.

따라서 전자가 n=1에서 무한대의 주양자수 궤도로 가기 위해서는 1R만큼의 에너지가 필요하다.
※ 어떤 물체의 내부에너지 차이 ΔE가 양수인 경우, 에너지가 물체로 흡수됨을 의미한다. 반대로 음수인 경우는 물체로부터 에너지가 방출됨을 의미한다.
■
보어의 가설

Niels Henrik David Bohr (1885-1962)
원자구조의 이해 뿐만 아니라 양자역학의 성립에도 크게 기여한 덴마크의 물리학자 닐스 보어는 수소원자에서의 에너지 준위를 다음과 같이 계산했다.
수소원자에서 전자의 에너지 준위

단위는 몰 당 킬로줄(kJ)로 n은 주양자수를 의미한다.
- 전자껍질의 에너지 준위 크기는 K(n=1)<L(n=2)<M(n=3)<... 순이다.

그림 2. 수소원자에서 전자의 에너지 준위

보어의 수소원자 모형을 통해 발머의 선 스펙트럼을 정확하게 해석했다.
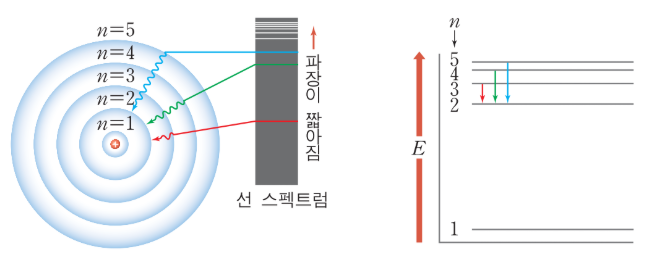
그림 3. 발머계열의 선스펙트럼과 보어의 수소원자 모형 간의 (에너지)관계
'대학화학' 카테고리의 다른 글
| [일반화학] 07. 슈뢰딩거의 파동역학 모델 (0) | 2020.02.29 |
|---|---|
| [일반화학] 06. 하이젠베르크의 불확정성 원리 (0) | 2020.02.28 |
| [일반화학] 04. 수소원자의 선 스펙트럼 (0) | 2020.02.28 |
| [일반화학] 03. 빛과 전자기파 (0) | 2020.02.27 |
| [일반화학] 02. 모즐리의 법칙 (0) | 2020.02.27 |