728x90
반응형

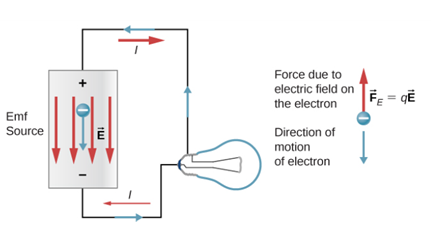
기전력(electromotive force, emf): 전기적 현상을 일으키는 ‘전위차’ ⇒ 직류회로에서 전지의 전위차(기전력)는 (비교적) 일정하다. → 그러므로 회로에 흐르는 전류의 방향과 크기도 일정하다.
- 전자·전기회로에서 전지(battery, cell)는 기전력의 원천이다.
- 전지의 기전력은 ε로 표현하며 전지 양단에 공급할 수 있는 최대의 전압을 뜻한다.
전지의 기전력
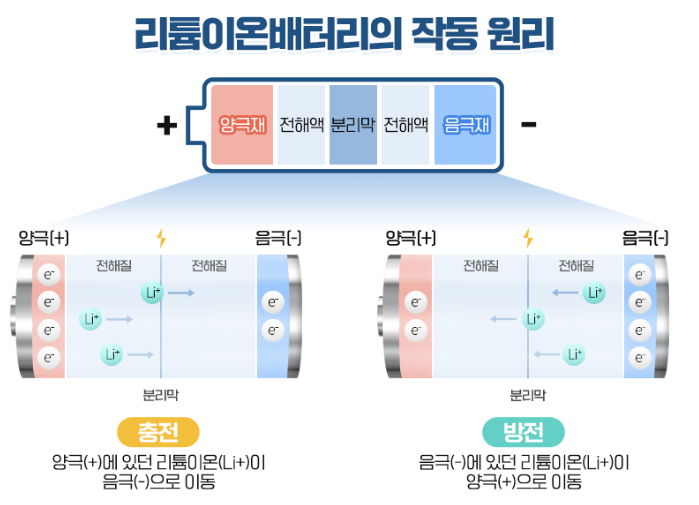
전지(battery): 건전지, 전지는 전기에너지를 전기화학적으로 저장한 에너지 변환 장치이다.
- 오늘날의 전지는 1800년 밀라노 공국 출신 이탈리아의 물리학자 알레산드로 볼타(Alessandro Volta, 1745-1827)가 발명한 볼타 전지를 기반으로 한다.

- 전지의 구성요소[그림 1]
- 전극(electrode): 산화·환원반응이 발생하는 곳으로 음극(anode)과 양극(cathode)으로 구분된다.
- 분리막(separator): 음극과 양극의 물리적 접촉을 차단하는 막
- 전해액(electrolyte): 이온의 이동이 일어나는 매개(medium), 전해액의 산도에 따라 알칼리, 산성 전지로 구분
음극: 전자를 공급하며 산화되는 전극으로 결과적으로 음극은 전자를 잃는다.
양극: 전자를 받으며 환원되는 전극으로 결과적으로 양극은 전자를 얻는다. ⇒ 전지의 성능향상을 위한 대상이 됨
※산화-환원 반응(oxidation reduction reaction): 서로 다른 화학종으로 전자가 이동하는 현상, (1)전자를 잃으면 산화, (2)전자를 얻으면 환원되었다고 표현한다. 이동된 전자의 개수는 항상 일정하다. 또한 두 화학종에 대한 산화-환원 반응은 항상 동시에 발생할 수 밖에 없다.
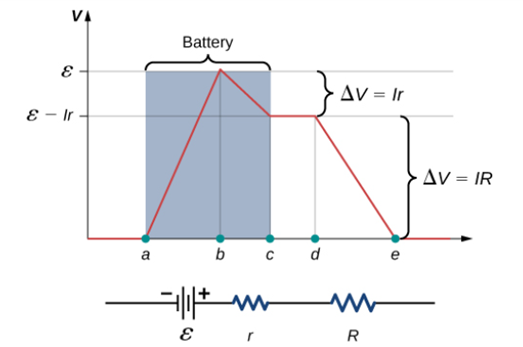
전지의 양단에 공급할 수 있는 최대 전압수치로 전지의 단자전압과는 아래와 같은 관계식을 가진다.
전지의 기전력
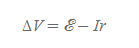
■
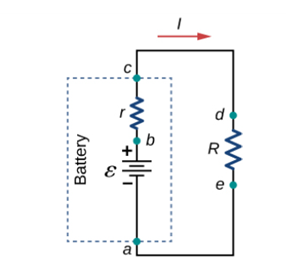
회로도[그림 4]에서 전지의 구성요소는 크게 (1)화학적 위치에너지를 공급하는 화합물 전원(power)과 (2)내부 저항(internal resistance)으로 나뉜다.[그림 2]
- 화합물 전원을 통해 전하 운반자는 전기적 위치에너지를 얻는다.
- 전지의 내부 저항에 의해 일부 전기적 위치에너지가 손실된다.
ΔV는 전지의 단자전압으로 전원과 내부저항을 동시에 고려한 전지의 알짜 전압[그림 3]을 뜻한다.


기전력의 정의
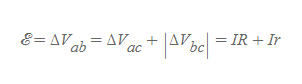
■
건전지의 전류
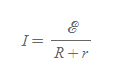
■
- 의미: 간단한 회로에서 건전지의 전류는 전지의 외부저항 R과 내부 저항 r에 모두 의존한다.
- 만약 R>>r이면 r은 무시할 수 있다.
건전지 총 출력
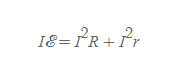
■
- ε=IR+Ir 식에 I를 곱하면 유도할 수 있다.
- 의미: 기전력 장치의 총 출력은 부하전하에서의 전력소모와 내부 저항에서의 전력 소모의 합과 같다.
728x90
반응형
'고급물리학 > 전자기학' 카테고리의 다른 글
| [물리학-전자기학] 22. 유전체 | Dielectric (1) | 2023.10.23 |
|---|---|
| [물리학-전자기학] 21. 축전기 연결 | Combinations of Capacitors (0) | 2023.10.22 |
| [물리학-전자기학] 19. 전자·전기회로 | Circuit (0) | 2023.10.15 |
| [물리학-전자기학] 18. 초전도체: 초전도 현상 | Superconductor: Superconductivity (0) | 2023.10.12 |
| [물리학-전자기학] 17. 초전도체: 온도와 저항의 관계 | Superconductor: Change in Resistivity with Temperature (0) | 2023.10.12 |