Herald-Lab
[일반화학] 10. 다전자 원자의 전자배치 본문

수소원자의 선 스펙트럼을 해석하면서, 과학자들은 원자 내의 전자가 일정한 궤도를 형성하며 궤도운동을 한다고 생각했다. 그러나 핵 주위의 전자가 2개 이상인 원자의 선 스펙트럼은 수소 원자보다 훨씬 복잡했고, 이후 복잡한 규칙을 발견하면서 이는 전자 간 반발력으로부터 유래함을 알게 되었다.
전자가 2개 이상인 원자를 다전자 원자라고 하며, 전자 간의 반발력에 의해 전자 배치는 3가지의 특수한 규칙을 갖는다.
1. 아우프바우 원리
2. 훈트의 규칙
3. 파울리의 배타 원리
Aufbau Principle
전자는 오비탈 궤도함수에 물질파의 형태로 존재하며, 주양자수와 각운동량 양자수, 그리고 자기양자수를 고려한 각각의 오비탈에는 전자가 최대 2개까지 채워질 수 있다. Aufbau principle은 축조원리라고도 한다.

그림 1. Aufbau principle
Aufbau principle의 주요 내용은 다음과 같다.
1. 바닥 상태에 있는 어떤 원자의 궤도함수에 전자가 채워질 경우, 에너지가 낮은 오비탈부터 채워진다.
2. 전자가 채워지는 오비탈의 순서는 다음과 같다.
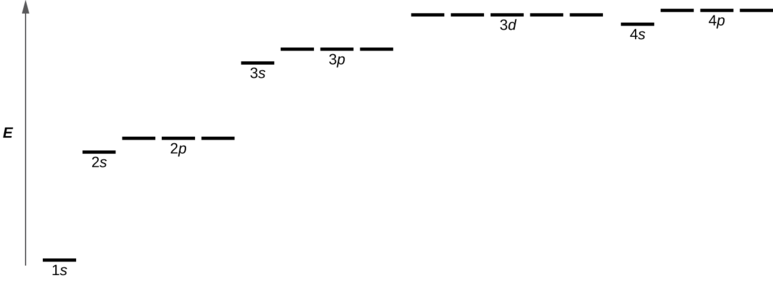
|
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → ... |

그림 2. The diagram of an electron configuration specifies the subshell and superscript number of electrons
Hund's Rule

Friedrich Hund (1896-1997)
독일의 물리학자 훈트가 발견한 규칙으로, 최대 다중도 규칙(maximum multiplicity rule)이라고도 불린다.
- 훈트의 규칙: 전자의 에너지 상태는 동일(주양자수와 각운동량 양자수가 동일)하지만 핵 주위의 공간적 배향이 달라, 자기양자수에 따라 서로 다른 오비탈에 전자가 채워질 때, 각각의 오비탈에 전자가 1개씩 먼저 채워진 후 전자쌍을 형성한다는 규칙
- 한 오비탈 내에 전자가 다른 오비탈들을 무시한 채 먼저 쌍(2개)을 이룬다면, 오비탈 내의 전자 간 반발력으로 인해 원자의 '불안정성'이 극도로 높아진다. 따라서 이러한 에너지 차원의 불안정성으로 인해 에너지가 동일한 2개 이상의 오비탈들은 전자가 채워질 때 최대한 홀전자를 이루게 된다.

그림 3. 탄소원자는 6개의 전자를 가지고 있고, 총 5개의 오비탈을 갖는다. 화살표는 spin을 반영한 전자의 기호로, 2p 오비탈(3개의 동일한 에너지 준위를 갖는)에서 2개의 전자는 홀전자 상태로 두 오비탈을 별도로 차지한다.

그림 4. 각 원소 별 Hund's rule이 적용된 전자배치도

그림 5. 전자의 spin: Electrons with spin values +1/2 and -1/2 in an external magnetic field
Pauli's Exclusion Principle
파울리의 배타원리: 한 원자 내의 어떠한 전자들도 네 개의 양자수가 모두 동일할 수 없다는 원리
- 핵 주위의 전자를 표현할 때 사용되는 4가지 양자수는 원자 내 각각의 전자에 대해 부여된 고유한 상태값으로, 4개의 양자수가 모두 동일한 전자는 존재하지 않는다.
- 예를 들어 두 전자가 서로 다른 오비탈에 있다는 것은 주양자수, 부양자수, 자기양자수 중 하나는 반드시 다름을 의미한다.
- 두 전자가 같은(한) 오비탈에 있다고 하더라도 둘의 스핀 양자수가 서로 정반대이다.
1. 한 오비탈 내에는 최대 2개의 전자까지만 채워질 수 있다.
2. 한 오비탈 내에 있는 전자들은 반드시 서로 전자의 스핀 방향이 다르다.
결국, 파울리의 배타원리는 전자가 가지는 스핀에너지의 차이를 설명하기 위해 도입되었다.

그림 6. 양자수의 종류와 특징