
열역학 제0법칙
열역학 제0법칙(zeroth law of thermodynamics): [열역학_02. 온도와 온도계], 만약 두 물체 A와 B가 제3의 물체인 C와 각각 열평형 상태에 있으면, A와 B는 서로 열평형 상태에 있다.
- 열평형(thermal equilibrium): 열접촉(thermal contact)상태에 놓인 두 물체 사이에 열이나 전자기 복사에 의한 알 에너지 교환이 더 이상 없는 상태
이상기체의 특성
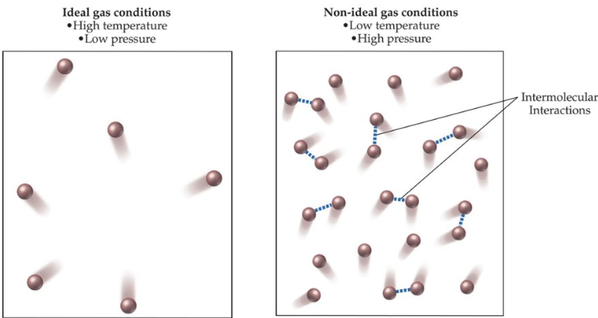
열역학 법칙이 적용되는 열역학적 계에는 '이상기체'들이 활동함을 가정하고, [그림 1]의 왼쪽 그림과 같은 이상기체의 거동은 아래의 특징들을 갖는다.
- 실제 기체일지라도 높은 온도와 낮은 압력 상태에서는 이상 기체에 가깝게 거동한다.
- 기체 분자 간의 힘이 매우 약해 분자 간의 상호작용(intermolecular interactions)을 무시한다.
- 기체 분자의 부피는 기체분자가 움직일 수 있는 공간적 크기에 비해 매우 작기 때문에, 대개는 그 값이 무시된다. 즉, 이상기체의 거동은 기체가 담긴 용기의 크기에도 의존한다. cf. 기체분자 자체의 부피는 무시될 수 있을 정도로 작다 가정한다.
- 열역학적 계 내의 압력이 낮은 조건에서 실제기체는 이상기체와 비슷하게 거동한다.
- 이상기체의 거동은 열역학적 기관이 사용하는 주요 동력원으로 작용한다.
열역학 변수 Thermodynamics Variables
일반적인 계의 형태 또는 계가 만족해야 하는 조건에 따라, 계의 상태(state)를 기술하기 위한 변수를 다음과 같이 사용한다.
- p: 압력, 기체 분자가 용기의 벽면이나 실린더의 면적에 가하는 힘으로 단위는 파스칼[Pa]을 쓴다.
- V: 부피, 기체분자가 움직일 수 있는 공간적 크기로 단위는 세제곱미터를 쓴다. e.g. 엔진의 실린더 내부의 부피
- T: 온도, 켈빈 온도를 사용한다. 단위는 [K]
- S: 엔트로피, 열역학적 계에서 일(work)로 변환이 불가능한 에너지의 흐름 또는 상태함수
- 켈빈 온도와 섭씨온도 차는 서로 같은 크기(1도씨 = 1 켈빈 온도)를 가지므로, 온도차(ΔT)가 들어간 물리량 계산에 한하여 섭씨 온도와 켈빈 온도는 서로 호환된다.
계를 구성하는 입자의 수가 바뀌는 열린 계에서는 두 가지의 변수가 추가적으로 고려된다.
- N: 계에 존재하는 실제 입자수
- μ: 화학 퍼텐셜(chemical potential), 주어진 온도에서 단위 입자 당 추가되는 자유에너지로, 입자를 추가할 때 발생하는 깁스 자유에너지의 증가량을 의미한다.
내부에너지 Internal Energy
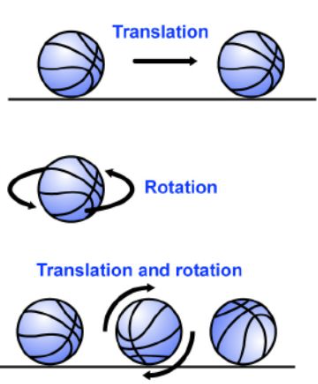
내부에너지: 열역학에서 내부에너지란, 계 전체가 공간을 이동할 때 발생하는 운동에너지를 제외한 분자들의 무질서한 병진(translation), 회전(rotation), 진동(vibration)[그림 2]에 의한 운동에너지, 그리고 분자 내 원자들 사이의 힘에 의한 위치에너지의 총합을 의미한다.
- 계를 구성하는 미시성분(원자나 분자)이 갖는 총 에너지로, 운동에너지와 퍼텐셜에너지를 제외한 모든 에너지의 총합과 같다.
- 내부에너지는 미시성분이 갖는 기계적인 에너지(mechanical energies)이다.
「Thermal energy is the sum of the mechanical energies of its molecules.」
내부에너지의 변화는 많은 경우 물체의 온도변화와 연관된다. 그러나 온도변화가 존재하지 않는 상변화(phase change)의 형태로 내부에너지의 변화가 나타나기도 한다.
- 내부에너지의 변화는 결국 (1)온도변화 양상과 (2)상변화 양상으로 나뉠 수 있다.
「A system’s internal energy is proportional to its temperature.」
열에 관한 오개념
열(heat): 기호로는 Q, 계와 주위 환경 사이의 온도차 때문에 계의 경계를 넘나드는 에너지의 전달로 에너지 자체가 아닌 '일'과 같다.
- 열은 물체가 가지는 에너지가 아니다. 그렇기 때문에 많은 열을 가진 물체가 뜨겁다는 표현은 잘못되었다. cf. 내부에너지가 클 때 물체는 뜨겁다.
- 열은 복사(radiation)가 아니다. e.g. 뜨거운 날에 도로는 (열이 아닌) 전자기 복사를 방출한다.
- 열은 주위 환경에 느껴지는 ‘온기’가 아니다.
- 열은 일처럼 에너지를 변환시키는 한 방법이다.
- 일(work)의 에너지 전환: (1)두 물체가 (2)힘이라는 물리량을 통해 (3)에너지의 유형을 변환
- 열(heat)의 에너지 전환: (1)두 물체(혹은 한 물체와 환경)가 (2)온도차이라는 물리량을 통해 (3)에너지의 유형을 변환
열의 에너지 전달적 측면은 잉글랜드의 물리학자 제임스 줄(James Prescott Joule, 1818-1889)이 그의 열기관 실험(1845)[그림 3] 및 논문을 통해서 '역학적 힘 → 유도 전류 → 열'로 전환됨을 밝혔다.

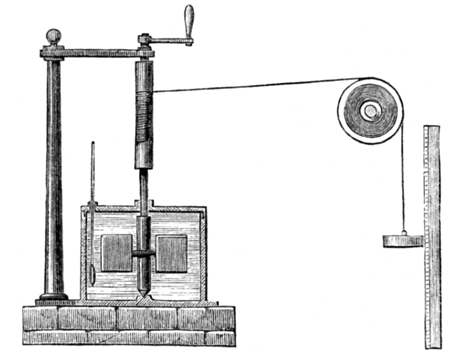
그가 근사해낸 열의 일당량(mechanical equivalent of heat)은 지금까지도 사용되고 있다.
- 열의 일당량: 1[cal] = 4.186[J], 1칼로리는 약 4.2줄의 에너지 값과 같다.
'고급물리학 > 열역학' 카테고리의 다른 글
| [물리학-열역학] 07. 반데르발스(판데르발스) 방정식 (공식 유도 포함) | Van der Waals Equation (0) | 2023.11.09 |
|---|---|
| [물리학-열역학] 06. 열역학 법칙: 이상기체 상태방정식 | Fundamental of Thermodynamics: The Ideal-gas Equation (0) | 2023.11.08 |
| [물리학-열역학] 04. 열응력 | Thermal Stress (0) | 2023.10.15 |
| [물리학-열역학] 03. 열팽창 | Thermal Expansion (0) | 2023.10.04 |
| [물리학-열역학] 02. 온도와 온도계 | Temperature and Thermometer (0) | 2023.09.30 |