
이상기체
Ideal Gases
이상기체(ideal gases): 기체의 상태방정식(equations of state)에 완벽하게 기인하여 거동하는 기체 ⇒ 여러 물질 상태들 중 가장 단순하여 이해하기 쉽다.
- 상태변수(state variables): 물질의 상태를 양적으로 나타내는 변수로 (1)압력 p, (2)부피 V, (3)온도 T, 그리고 (4)물질의 양(미지의 몰 수) n이 있다.
물질의 부피는 압력, 온도, 물질의 양에 의해 결정된다. ⇒ 상태변수는 다변수함수이다.
- 부피를 결정하는 인자들을 독립적으로 변화시킬 수 없다. ⇒ 온도를 증가시키면 부피뿐만 아니라 압력도 함께 커진다.
- 상태변수의 관계를 상태방정식으로 간단히 표현할 수 있다.
이상기체 상태방정식
The Ideal-gas Equation
물질의 시료 질량은 기본적으로 아래 식을 따른다.
시료 질량
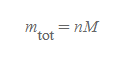
■
- n: 몰 수
- M: 몰질량(molar mass)
일반적으로 1몰은 아보가드로 수(Avogardro's number)와 같고, 6.022×10^23[개]의 입자 수를 뜻한다.

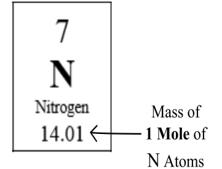
그리고 몰질량은 어떤 원자 또는 분자가 1몰개가 있을 때의 표준 질량[그림 1]으로, 단위는 [g/mol]을 일반적으로 쓴다. 주기율표 상에서는 [그림 2]와 같이 제시된 원소가 아보가드로 수만큼 있을 때의 몰질량을 보여다.
기체의 성질
기체의 여러가지 상태변수는 특수한 조건에 따라 다양한 비례, 반비례 관계를 보인다.
아보가드로의 법칙
등온, 등압 조건에서 동일한 수의 기체 분자들은 기체의 종류에 상관없이 같은 부피를 차지한다. 또한 기체의 부피는 기체의 몰수에 비례한다. 압력과 온도를 일정히 유지하면서 몰수를 2배로 하면 기체의 부피도 2배가 된다.
- 여기서 기체의 부피란 기체들이 차지하는 공간으로서의 부피로 기체 자체가 가진 체적과는 전혀 다른 개념이다.
- 그의 첫 번째 문장은 0도씨 1기압(1[atm]) 조건에서 이상기체는 어떠한 기체든 상관없이 1몰개가 22.4L의 공간을 차지함을 의미한다.
- 다음 두 번째 문장은 압력과 온도가 일정한 조건에서 미소공간에 이상기체를 2배 넣으면, 그 미소공간도 2배 팽창될 수 있음을 뜻한다. ⇒ 기체의 공간적 운동 가동범위를 활용하고자 하는 열역학에서 기체의 부피의 변화 요인은 매우 중요한 개념이다.
아보가드로의 법칙 | Avogadro's Law
■
보일의 법칙

보일의 법칙(Boyle's law): 아일랜드 출생 잉글랜드의 자연철학자 보일(Robert Boyle, 1627~1691)이 기체의 실험을 통해서 확인한 사실로, 온도와 물질의 양을 일정히 하는 조건 하에 기체의 부피는 기체의 압력에 반비례함[그림 3]을 발견(1662)했다.
- 일정한 온도 하에 pV는 항상 일정하다.
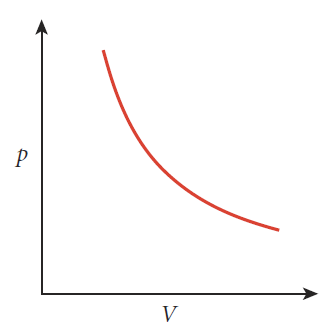
보일의 법칙

■
- 물리량
- V: 기체의 부피
- p: 기체가 부피에 가하는 압력
샤를의 법칙

프랑스의 물리학자인 샤를(Jacques Alexandre. C. Charles, 1746~1823)이 발견(1787년 경)하고 게이뤼삭이 1802년에 발표한 기체 성질에 관한 법칙, 기체의 부피는 온도가 높아질 수록 그 부피가 증가[그림 4]한다. 단, 기체에 대한 압력과 물질의 양은 일정하게 맞춘다.
샤를의 법칙
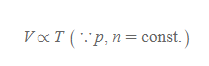
■
게이 뤼삭의 법칙

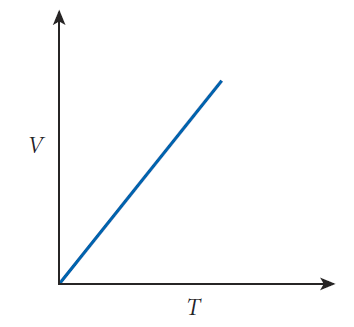
게이 뤼삭의 법칙: 기체의 부피가 일정할 때, 기체의 압력은 기체에 대한 온도가 증가할수록 함께 증가[그림 5]한다.
게이 뤼삭의 법칙
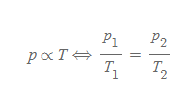
■

이상기체 상태방정식 세우기
위의 4가지 경험적 식들을 조합하여 이상기체 상태방정식을 세울 수 있다.

여기서 k_4는 볼츠만 상수 k_B에서 등장하는 기체상수 R과 실험적으로 일치한다.
기체상수(universal gas constant)
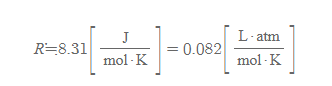
- 이상기체 상태방정식으로부터 기체상수 값을 구할 때, 물리량의 쓰이는 단위에 따라 그 수치가 다르다. 8.31의 수치에서 줄 단위[J]는 열역학적 계에서 기체의 일 식이 W=pV인 사실로부터 유도되었다.
이 값을 그대로 식에 대입하면 이상기체 상태방정식을 얻을 수 있다.
이상기체 상태방정식 | Ideal Gas Equation
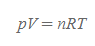
■
- 물리량
- p: 기체의 압력 ⇒ 기체분자에 작용한 외부압력을 의미
- V: 기체의 부피(volume) ⇒ 기체입자가 자유롭게 움직이며 차지할 수 있는 공간
- n: 기체의 몰수
- R: 기체상수(gas constant), 비례상수로 어떠한 물리량과 결합하느냐에 따라 크기가 달라진다.
- T: 절대온도로 켈빈 단위를 사용한다.
이상기체방정식은 충분히 높은 온도와 낮은 압력 하에서 실제 기체의 거동도 일부 설명할 수 있다. cf. 그러나 기체의 액화점이 높으면 이상기체방정식으로 설명하기 어렵다.
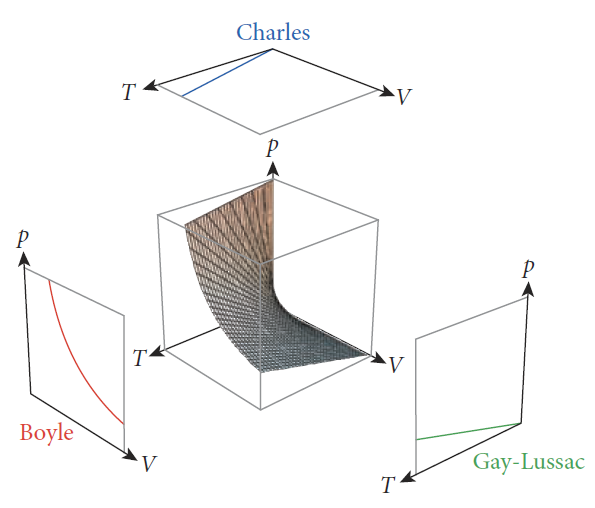
또한 이상기체 상태방정식은 3차원의 그래프[그림 6]로도 나타낼 수 있는데, 컴퓨터를 사용하여 특수한 조건(충분히 높은 온도, 낮은 압력) 내의 이상기체의 거동을 예측하는데 활용한다.
'고급물리학 > 열역학' 카테고리의 다른 글
| [물리학-열역학] 08. 볼츠만 상수 | Boltzmann Constant (0) | 2023.11.10 |
|---|---|
| [물리학-열역학] 07. 반데르발스(판데르발스) 방정식 (공식 유도 포함) | Van der Waals Equation (0) | 2023.11.09 |
| [물리학-열역학] 05. 열역학 법칙: 기본개념 | Fundamental of Thermodynamics: Basic Concepts (0) | 2023.10.25 |
| [물리학-열역학] 04. 열응력 | Thermal Stress (0) | 2023.10.15 |
| [물리학-열역학] 03. 열팽창 | Thermal Expansion (0) | 2023.10.04 |