
원자번호에 따른 전자배치(electron configuration)는 오비탈 도식(orbital diagram)에서 아래와 같이 나타난다.
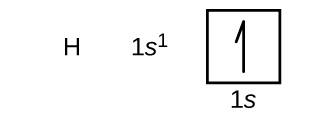
그림 1. 수소의 오비탈 도식
오비탈 도식에서 오비탈은 □이고, 전자는 ↑로 나타낸다. 주의할 점은 전자를 나타내는 화살표의 머리가 완전하게 그려지면 안된다는 점인데, 이는 화살표 머리가 전자의 특정한 spin을 가리키기 때문이다.
즉, 전자가 갖는 2가지 스핀은 다음과 같이 구분되어 표시된다.

전자가 가질 수 있는 두 가지 스핀(+1/2, -1/2)은 반쪽 화살표 머리로 구분된다.
수소의 오비탈 도식 외에 나머지 원소의 오비탈 도식은 아래 그림들로부터 확인할 수 있다.


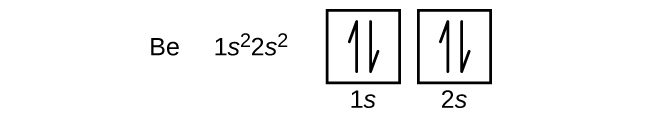



리튬(Li)은 헬륨의 오비탈이 전부 다 찬 상태에서 2s 오비탈에 1개의 전자가 더 채워진 원자와 같다. 따라서 약어로 다음과 같이 쓰기도 한다.

[He]은 핵심전자(core electrons)을 의미하고, 2s^1의 1은 최외각전자(valence electron)과 같다.
같은 논리로 소듐(Na)이온은 다음과 같이 쓸 수 있다.


그림 2. Core electrons and Valence electrons
전이 원소의 전자배치도
1. 4주기 원소를 기준으로 4s 오비탈이 먼저 채워진 뒤, 3d 오비탈이 채워진다.
- 4s오비탈은 3d오비탈과 매우 비슷한 에너지 준위를 갖는다. (정확하게는 4s오비탈이 3d오비탈보다 에너지 준위가 '약간' 낮다.) 따라서 적어도 4s오비탈에 전자가 한 개는 채워진다. ⇒ 주양자수가 크더라도 각운동량 양자수에 따라 오비탈의 에너지 준위가 더 낮을 수 있다.
- 침투효과
- 전자 가리움 효과
2. 전자배치 예외법칙(exceptional configuration): 중성 상태의 4주기 전이금속 원소의 원자가 전자는 1개 또는 2개이며, 24번 크롬과 29번 구리의 4s 오비탈에는 전자가 1개씩 존재한다.

오비탈의 구형대칭성
1. 한 원자의 오비탈에 채워진 전자 간 반발력이 최소화되기 위해서는 전자들이 가능한 구형을 이루어야 한다.
2. 전형원소는 1, 2, 15, 18족 원소의 바닥상태 전자구름이 구형이다.
3. 전이원소는 4주기 원소를 기준으로 크롬, 망가니즈(Mn), 구리, 아연(Zn)의 바닥상태 전자구름이 구형이다.
'대학화학' 카테고리의 다른 글
| [일반화학] 13. 수소원자의 분석 [심화] (0) | 2020.03.04 |
|---|---|
| [일반화학] 12. 원자 반지름과 이온 반지름 (0) | 2020.03.04 |
| [일반화학] 09. 오비탈과 노드(매듭면) (0) | 2020.02.29 |
| [일반화학] 08. 네 가지 양자수 (0) | 2020.02.29 |
| [일반화학] 07. 슈뢰딩거의 파동역학 모델 (0) | 2020.02.29 |