반응형
250x250
Notice
Recent Posts
Recent Comments
Link
Herald-Lab
[물리학-현대물리학] 이온결합 | Ionic Bonding 본문
728x90
반응형

이온결합(ionic bond): 금속과 비금속 이온 또는 암모니움과 같은 다중 원자 사이에서 형성된 화학결합의 한 형태
- 전자의 이동[그림 1]으로 인한 이온 간의 정전기적 인력으로 결합이 생성된다.

- 전형 원소 중, 알칼리 금속과 알칼리 토금속은 원자가 전자 수가 적어 이온화 에너지가 적기 때문에 전자를 잃어버리기 쉽다. ⇒ 양이온이 되기 쉽다. cf. 반면, 15~17족 원소들은 전자부족으로 이온화 에너지가 커 전자를 얻기 쉽다. ⇒ 음이온이 되기 쉽다.

이온결합[그림 2]은 이온쌍 사이의 결합으로 중성분자 사이의 상호작용과 자주 비교된다.

이온결합의 퍼텐셜에너지

■
- 소금은 대표적인 이온결합 화합물로 높은 온도로 가열하면 증발이 일어나 이온쌍이 만들어 지는데[그림 3], 이들 사이의 인력을 쿨롱의 법칙으로 유도할 수 있다.
- 물리량
- q_+: 양이온의 전하량
- q_-: 음이온의 전하량
- r: 두 이온 사이의 거리
- ε: 공간의 매질이 공기라면 유전상수는 1에 근사한 값으로 표현한다.

이온결합의 퍼텐셜에너지 식으로 염화소듐의 퍼텐셜에너지를 다음과 같이 구할 수 있다.
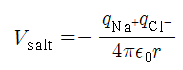
그러나 퍼텐셜에너지의 정확한 표현은 이들 각각의 이온을 구성하는 전자들 간의 상호 반발력과 핵 간 반발력을 고려한 식이다.

- 물리량
- b는 상수 값으로 이온쌍에 따라 결정된다.
- n은 8~12 사이의 정수이다.
소듐클로라이드 이온결합 퍼텐셜에너지

[1] 퍼텐셜 에너지 곡선의 최소점(F=0)에서 기울기 dV/dr=0이 되므로, b 값을 구할 수 있다.
- dV/dr = 0, r = r_e은 F=0, r=r_e와 의미가 서로 같다.
- F = 0이면 -dV/dr = 0도 성립한다.

- 위 식에서 r_e는 이온쌍의 평형결합길이로 두 이온이 가장 안정하게 이온결합을 할 수 있는 길이를 뜻한다.
[2] 식을 계산하면 b는 다음과 같다.

[3] b식을 V=V_salt+(b/r^n)식에 대입하면 다음과 같이 정리할 수 있다.

여기서 V_0는 가장 안정한 거리에서의 이온결합의 퍼텐셜에너지이다. 염화수소 기체의 결합길이는 대략 236pm, 단위 전하는 1.602×10^-19[C], 반발력에 대해 n=10이라고 하면 1몰의 소듐 이온과 염소 이온의 이온쌍에 대한 퍼텐셜에너지는 다음과 같이 계산한다.

- 피코미터(pm)단위를 반드시 m 단위로 환산한다.
1몰의 기체 소금 이온쌍의 안정 퍼텐셜에너지는 약 –529.7[kJ/moL]이다. 이는 기체 상태의 소듐이온과 염소 이온들로부터 1몰의 염화수소쌍이 만들어 질 때 발생하는 에너지(발열; 실험 시 열에너지로 발산하는 화학반응)이다.
소듐클로라이드의 화학식



728x90
반응형
'고급물리학 > 현대물리학' 카테고리의 다른 글
| [물리학-현대물리학] 23. 드브로이 물질파 | Matter Wave(de Broglie Wave) (0) | 2023.12.29 |
|---|---|
| 【현대물리학】 복소수 (0) | 2021.12.01 |
| 【현대물리학】 확률밀도와 정규화 (w/ 구면극좌표) (0) | 2021.11.30 |
| 【현대물리학】 확률, 확률밀도, 그리고 보른의 해석 (0) | 2021.11.30 |
| 【현대물리학】 슈뢰딩거 방정식 (0) | 2021.11.30 |