Herald-Lab
열역학 학습을 위한 열화학 기초 본문
열역학에서의 용어: 계, 상태, 그리고 과정
열역학의 다양한 상황을 공식화하는 데 있어 엄밀한 열역학적 용어사용은 매우 중요하며, 기준에 따라 사용하는 식의 모양이 달라진다.
- 계(system): 특정한 실험이나 연구 수행에 직접적인 관심의 대상이 되는 우주의 한 부분 계는 경계(boundary; 계의 경계)가 주위와 물질 및 에너지 교환을 허용하는 정도에 따라 크게 3가지로 분류된다.
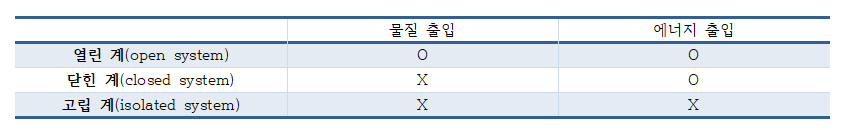
- 주위(surroundings): 우주에서 계를 제외한 나머지 부분
열역학적 과정이 진행되는 동안 계의 성질을 변화시키는 외부의 힘(외력)을 제공한다.

계의 성질
어떤 계의 중간에 얇은 벽을 설치해 그 계를 두 개의 부분계(subsystems)로 나누고 각각의 부분계를 초기 계와 마찬가지로 몇 가지 성질들로 기술한다.
1. 크기 성질(extensive property): 두 부분계가 가진 해당 성질의 합으로 초기계의 성질을 설명할 수 있다. e.g. 질량, 부피, 에너지 초기 계의 부피는 두 부분계의 부피의 합과 같다.
2. 세기 성질(intensive property): 두 부분계 중 어떠한 계라도 그 해당 성질이 초기계와 성질을 설명할 수 있다. e.g. 온도, 압력 25도씨의 방안을 두 구획으로 나누어도 한 구획 안의 온도는 여전히 25도씨이다.
엔탈피 Enthalpy
열역학 계는 열을 전달하거나 일을 하는 것으로 주위와 에너지 교환을 할 수 있다.

- 부피가 일정하게 유지되는 계는 일을 하지 않는다. 계로 들어오는 열에너지에 의해 계는 오로지 내부에너지만 변한다.
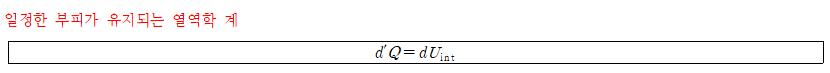
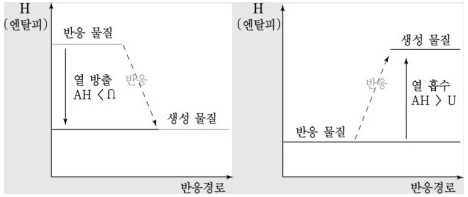
부피가 변화할 수 있는 용기 내에 열에너지를 공급하면 부피는 변화하나 압력은 일정하게 유지된다. ⇒ 일정한 압력 값을 유지하는 계에 공급된 열에너지를 엔탈피(enthalpy)라고 정의한다.
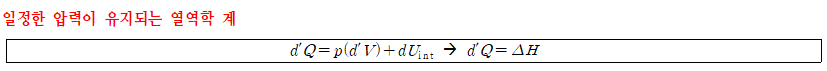
- 프로판 연소반응을 일정한 압력 하에 발생시키면, 계는 소량의 부피 팽창을 통해 일을 하고 나머지 에너지는 열로 발산시킨다.
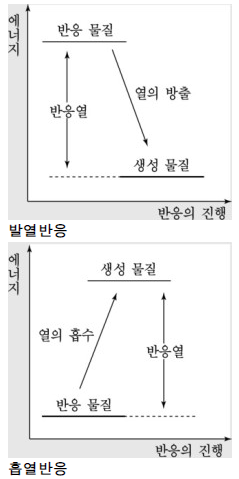
자발성
자발적 과정(spontaneous process): 계의 외부조건과 관계없이 계 그 자체가 자발적으로 진행하는 과정(변화) ⇒ 물리적 변화와 함께 화학적 변화도 자발적 과정에 속할 수 있다.
▶물리적 변화: 물질의 구조가 변하는 과정 e.g. 소금결정을 망치로 내려쳤을 때, 결정구조는 깨지지만 소금구조는 여전히 (전기력에 의해)유지된다.
▶화학적 변화: 물질의 본질이 변하는 과정 e.g. 소금을 전기적으로 분해했을 때 소듐이온(Na+)은 음극으로 끌리는 반면 염소이온(Cl-)는 양극으로 끌린다.
자발적 과정의 특징
1. 자발적 과정은 평형을 향해 계를 변화시킨다. 평형 상태에 도달할 때 까지 계는 자발적으로 변화한다.
2. 비자발적인 과정의 발생은 계의 외부조건에 달렸다.
3. 자발적인 과정은 계의 변화 속도(반응 속도)와 무관하다. cf. 화학반응이 일어나는 계의 경우, 자발적 과정의 속도는 활성화 에너지의 크기와 계의 절대온도의해 결정된다.
깁스자유에너지 Gibbs Free Energy

미국의 수리물리학자 윌라드 깁스(Josiah Willard Gibbs, 1839~1903)가 제안한 개념으로 물리화학적 변화의 자발성을 설명한다.
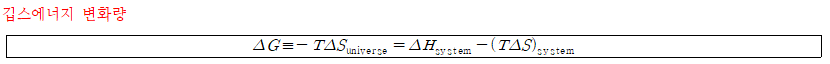
- 의미: 깁스에너지 변화량의 부호를 통해 물리화학적 변화의 자발성을 확인할 수 있다.


PROOF. 깁스 자유에너지 유도
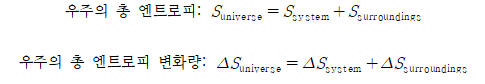

- 열역학적 주위는 일정한 온도가 유지되면서 계에 대한 열원(heat bath)과 같이 작동한다.

- 조건: 어떤 계가 한 평형상태에서 다른 평형상태로 바뀌는 매우 짧은 과정이다.

- 일정한 압력이 유지되는 열역학 계 조건으로 변화는 가역과정이라 볼 수 있다. 따라서 열에너지의 변화량은 엔탈피 변화량으로 해석하고 엔트로피의 변화량 식을 사용할 수 있다.
- 가역과정에서 극소시간의 주위온도와 계의 온도는 거의 같다.
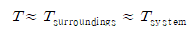
'고급물리학' 카테고리의 다른 글
| 반사와 굴절 (0) | 2021.12.11 |
|---|---|
| 가우스의 법칙 (0) | 2021.12.05 |
| 다차원 상의 운동 (0) | 2021.11.27 |
| 지진파 Seismic Wave – 지진파의 이해 (0) | 2021.11.26 |
| 신경세포와 근육세포 (0) | 2021.11.21 |